2025年7月1日 ,上海交通大学章雪晴团队与新泽西理工学院许晓阳团队在期刊《Nature Communications》上发表题为" Budesonide-incorporated inhalable lipid nanoparticles for antiTSLP nanobody mRNA delivery to treat steroid-resistant asthma "的研究论文。

研究团队使用ag尊龙凯时MPE-L2型微流控制备仪制备mnbTSLP-iLNP纳米粒,经雾化吸入肺部后,借助膜融合和GR介导的内吞作用进入细胞,逃离溶酶体后释放 mnbTSLP和布地奈德。mnbTSLP在体内翻译为nbTSLP,中和气道过量TSLP,抑制STAT3和p38磷酸化,恢复布地奈德敏感性,GR复合物入核调控炎症基因转录,协同改善哮喘症状。

研究背景
本研究创新构建甾体结构化的新型吸入式LNP递送系统,通过布地奈德等甾体分子与脂质骨架的疏水嵌合设计,实现编码抗胸腺基质淋巴细胞生成素(TSLP)纳米抗体mRNA(mnbTSLP)的肺靶向吸入递送,实现了甾体抗炎药物与抗体药物在肺部的靶向富集及协同作用。通过调控气道炎症微环境与阻断TSLP介导的2型炎症通路,为重症难治性哮喘提供兼具快速起效与免疫调节优势的创新治疗方案,克服重症哮喘中糖皮质激素耐药的挑战。
1.ASCEND(替代类固醇与mRNA编码纳米体共同递送)疗法作用机制示意图

图例1:si-VPNs制备过程
? mnbTSLP-iLNP制备工艺:

图例2:mnbTSLP-iLNP制备工艺
2. mRNA-iLNP制剂的制备与筛选
研究团队通过制备不同布地奈德摩尔占比(0%、5%、9.5%、14%、19%)的iLNP ,对比雾化前后粒径、PDI、zeta电位及包封效率,发现5%布地奈德组(iLNPBUD5)雾化后稳定性最佳,体外转染BEAS-2B细胞的EGFP阳性率最高(约72%),且转染效率依赖GR介导的内吞作用。体内实验显示,iLNPBUD5在肺部靶向性强,荧光信号显著高于其他制剂及ALC-0315对照组,这些结果表明,含5%BUD的LNP(mRNA-iLNPBUD5)的理化稳定性和递送效率佳。

图例3:雾化递送用 mRNA-iLNP 制剂的制备与筛选
3. mRNA-iLNPBUD5的雾化递送特性表征
接着,研究团队进一步验证iLNPBUD5的关键递送性能。冷冻电镜显示其雾化前后均为球形、粒径均一;4℃储存30天仍保持胶体稳定性,ag尊龙凯时在中性和弱酸性生理环境中结构稳定。体外黏液渗透实验表明,iLNPBUD5介导的mRNA穿透效率显著高于游离mRNA;16HBE细胞溶酶体逃逸实验显示,mRNA在4小时内从溶酶体释放至细胞质,转染后呈现强且均一的EGFP表达,且无细胞毒性。这些结果表明,mRNA-iLNPBUD5具有良好的稳定性、对雾化诱导损伤的耐受性、良好的黏膜穿透性、转染效率高,以及良好的安全性,是一种有前景的可吸入mRNA治疗载体。
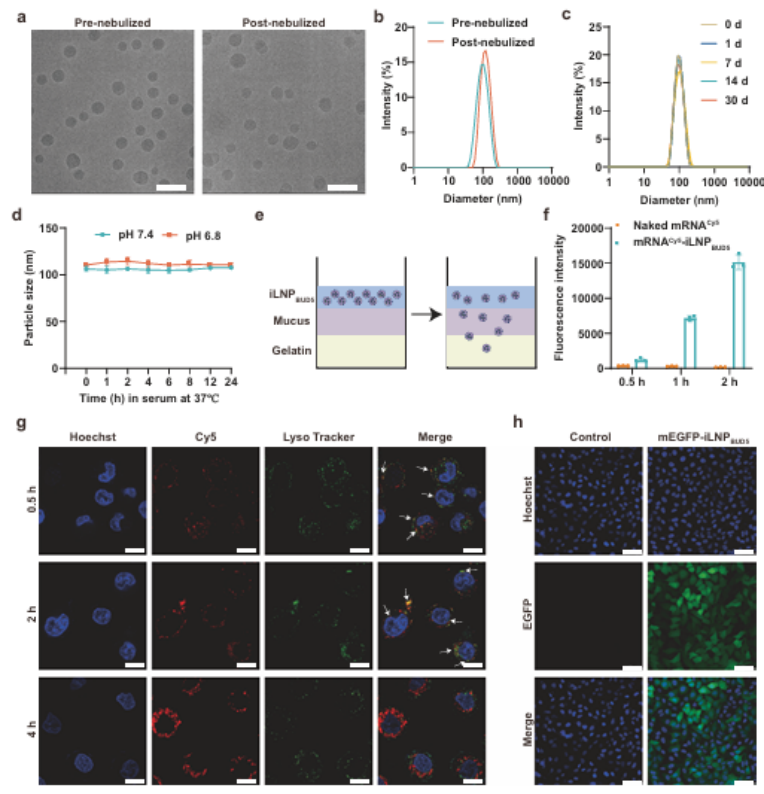
图例4:mRNA-iLNPBUD5的雾化递送特性表征
4.mnbTSLP的设计与体外功能验证
随后,研究团队进行了mnbTSLP的序列设计和体外验证。琼脂糖凝胶电泳和WB实验结果表明mnbTSLP编码抗TSLP纳米抗体,iLNPBUD5可保护其免受血清降解,介导nbTSLP剂量/时间依赖型表达;nbTSLP与TSLP高亲和力结合,显著抑制炎症因子表达,这为治疗实验中确定最佳给药间隔提供了有价值的见解。
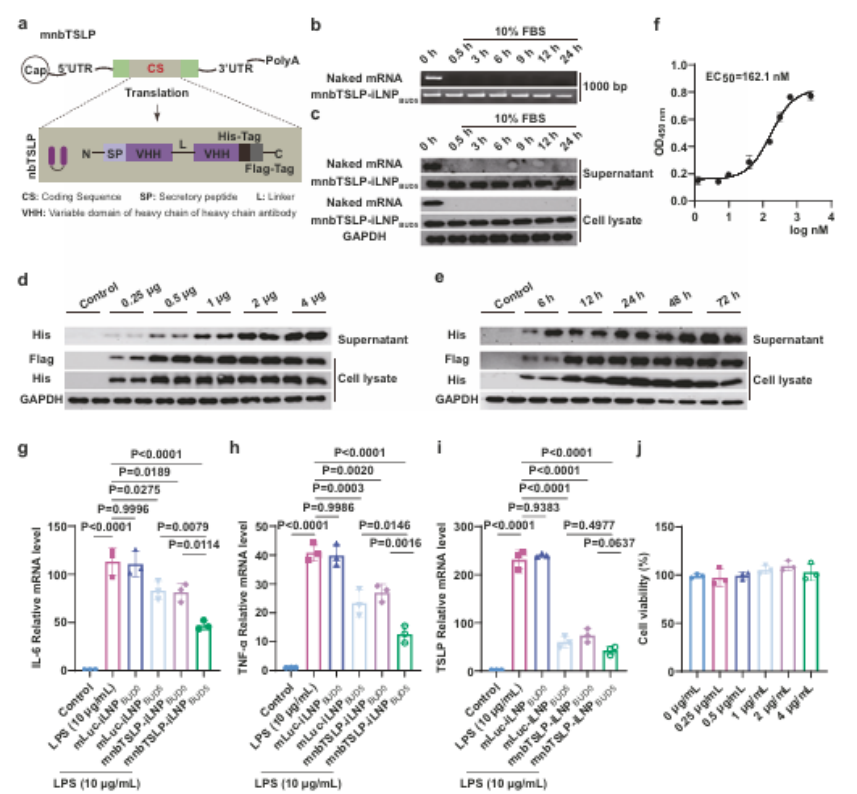
图例5:mnbTSLP的设计与体外功能验证
5.mnbTSLP-iLNPBUD5缓解OVA诱导的急性哮喘气道损伤
模型构建:第 1、7、14天腹腔注射OVA+明矾致敏,第21-27天每日鼻内注射50μg OVA激发。
给药方法:每次OVA激发前6小时,吸入给药(mLuc-iLNPBUD0、Pulmicort、mLuc-iLNPBUD5、mnbTSLP-iLNPBUD0、mnbTSLP-iLNPBUD5),健康组给予PBS。
在OVA诱导急性哮喘模型中,研究团队发现mnbTSLP-iLNPBUD5显著降低了气道壁厚度、炎症浸润、黏液分泌及胶原沉积,指标接近健康组,优于单药治疗。
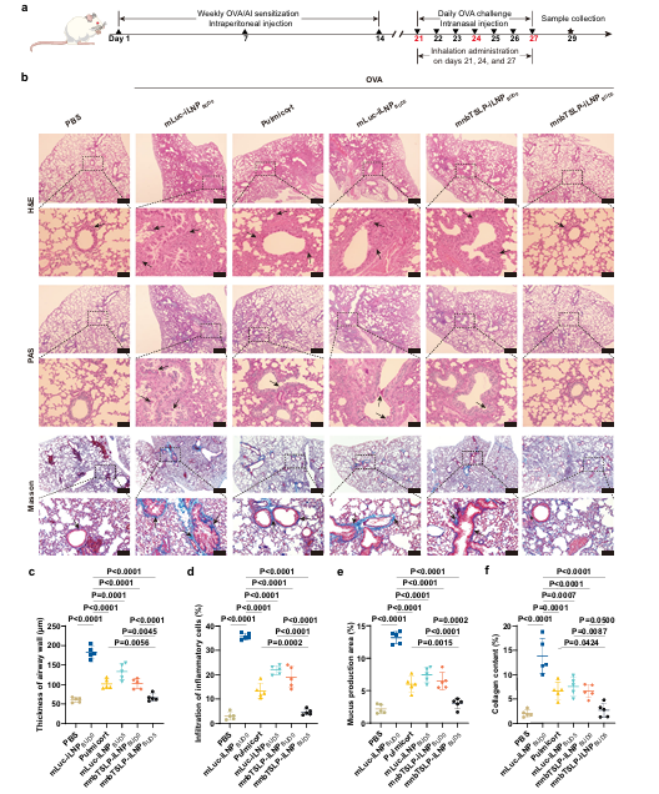
图例6:mnbTSLP-iLNPBUD5缓解OVA诱导的急性哮喘气道损伤
6.mnbTSLP-iLNPBUD5改善重症哮喘的气道炎症与肺功能
模型构建: OVA+明矾致敏+高剂量OVA激发
给药方法:通过吸入方式给予对应制剂,单次mRNA剂量30μg,布地奈德剂量按分组设定。
而在OVA诱导重症哮喘模型中,研究团队发现mnbTSLP-iLNPBUD5 组的BALF炎症细胞、血清IgE及炎症因子水平大幅降低;气道对乙酰甲胆碱反应平缓,AHR 症状显著缓解,肺功能改善明显。
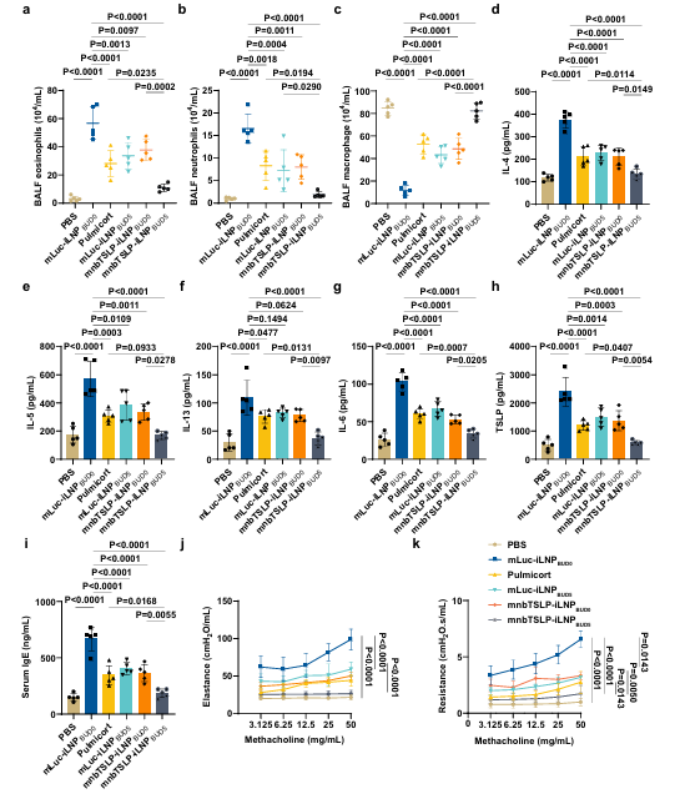
图例7: mnbTSLP-iLNPBUD5改善重症哮喘的气道炎症与肺功能
7.mnbTSLP-iLNPBUD5在类固醇抵抗性哮喘中的协同治疗作用
模型构建:第 1、7、14天腹腔注射OVA+明矾致敏,第21-70天每周3次鼻内注射20μg OVA+10μg TSLP激发。
给药方法:第56-70天,每周1次给药,mnbTSLP-iLNP系列制剂通过吸入给予,Tezepelumab经尾静脉注射(70μg /次),其他对照组按对应方式给药。
在OVA/TSLP诱导类固醇抵抗性哮喘模型中,研究团队发现布地奈德单药无效,mnbTSLP-iLNPBUD5可维持低气道阻力,抑制炎症与重塑,降低p-STAT3/p-p38水平,恢复药物敏感性。

图例8:mnbTSLP-iLNPBUD5在类固醇抵抗性哮喘中的协同治疗作用
8.mnbTSLP-iLNPBUD5的体内安全性评估
连续吸入给药后,小鼠体重、生化指标、血常规无异常,心肝肾脾无病理改变,全身安全性良好。
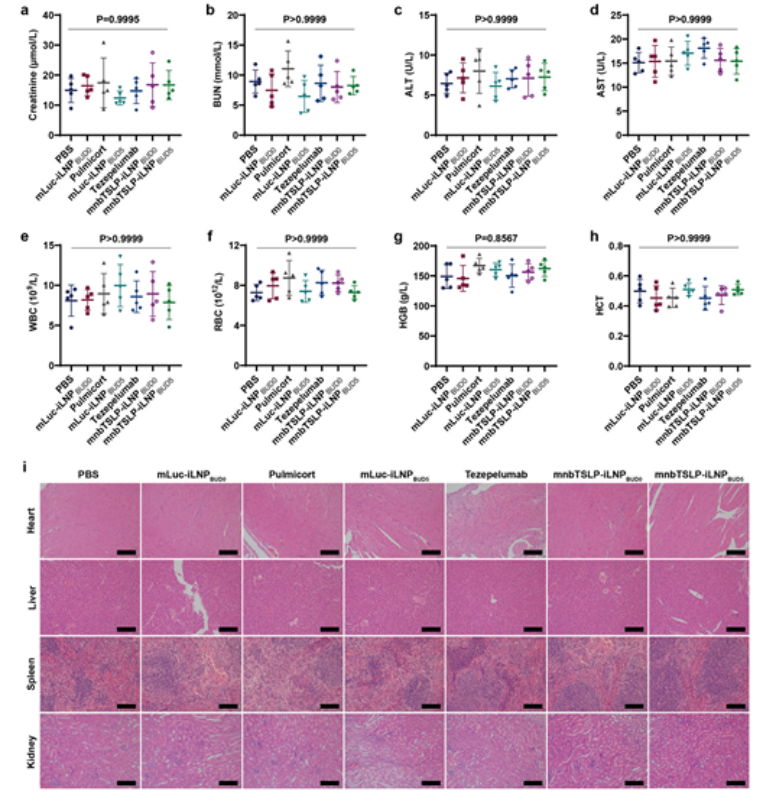
图例9:mnbTSLP-iLNPBUD5的体内安全性评估
知识分享:研究亮点
1 通过组分配方、制备工艺、雾化体系等研究变量的多维度协同优化,并在此基础上整合抗哮喘甾体药物为结构成分,构建新型吸入式mRNA-LNP体系,实现小分子和核酸药物针对肺部的精准递送;
2 协同抗炎作用:依托载体与核酸药物的协同效应,显著抑制气道炎症及TSLP信号通路,联合疗法显著减轻小鼠模型的气道炎症、重塑和高反应性,且mnbTSLP通过抑制关键炎症通路,恢复哮喘小鼠对布地奈德的敏感性;
3 患者依从性高:该策略采用非侵入性吸入给药,操作简便,患者接受度高,具有广阔的临床应用前景。
参考文献:
Nature Communications ( IF15.7 ) Pub Date :2025-07-01,DOI: 10.1038/s41467-025-61114-4.
 欢迎来到ag尊龙凯时网站!
欢迎来到ag尊龙凯时网站! 欢迎来到ag尊龙凯时网站!
欢迎来到ag尊龙凯时网站!










