2024年6月22日,一篇题为"Robust anti-tumor immunity through the integration of targeted lipid nanoparticle-based mRNA nanovaccines with PD-1/PD-L1 blockade "的研究论文,发表在《Materials Today Bio》杂志上。

本研究创新构建了一种靶向纳米疫苗平台,利用ag尊龙凯时MPE-L2型微流控制备仪制备甘露糖修饰的脂质纳米颗粒(TLNP),同时负载肿瘤抗原mRNA(如mOVA)和cGAMP(环磷酸鸟苷-腺苷酸)佐剂,形成靶向纳米疫苗(TNVs),实现对抗原呈递细胞的特异性靶向,提升抗原递送与免疫激活效率。通过优化mRNA疫苗的靶向递送能力,并与免疫检查点阻断疗法结合,解决传统mRNA疫苗递送不足、免疫激活有限及肿瘤微环境抑制的问题,最终增强抗肿瘤免疫应答。

作用机制
靶向纳米疫苗(TNVs)进入抗原呈递细胞(APCs)后,其携带的mRNA翻译生成肿瘤抗原,经MHCⅠ/Ⅱ类分子呈递,激活CD8?细胞毒性T细胞与CD4?辅助T细胞,而抗PD-L1抗体通过阻断肿瘤细胞PD-L1与T细胞PD-1的结合逆转免疫抑制,二者协同作用可增强肿瘤浸润免疫细胞活性,诱导免疫记忆,从而抑制肿瘤复发与转移。

图例1:靶向纳米疫苗制备与作用机制
? 配方摩尔比:
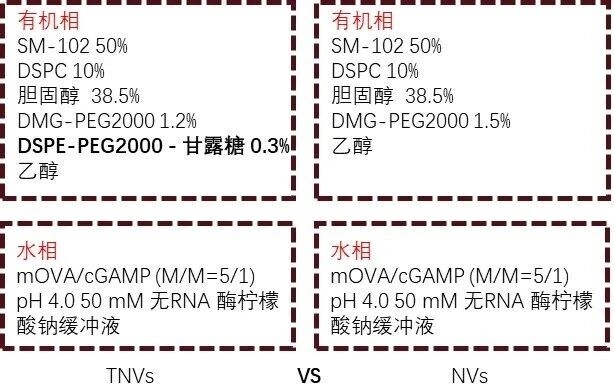
图例2:靶向纳米疫苗配方摩尔比
1. 纳米疫苗的设计与表征
首先,研究团队通过微流控技术制备了非靶向(NVs)与靶向(TNVs)两种纳米疫苗,并完成表征与稳定性验证,结果显示二者粒径均为80-85nm、PDI:0.05-0.09,呈均一球形,mRNA包封率超97%,且4℃储存在28天内性能稳定,为后续实验提供了合格的载体基础。
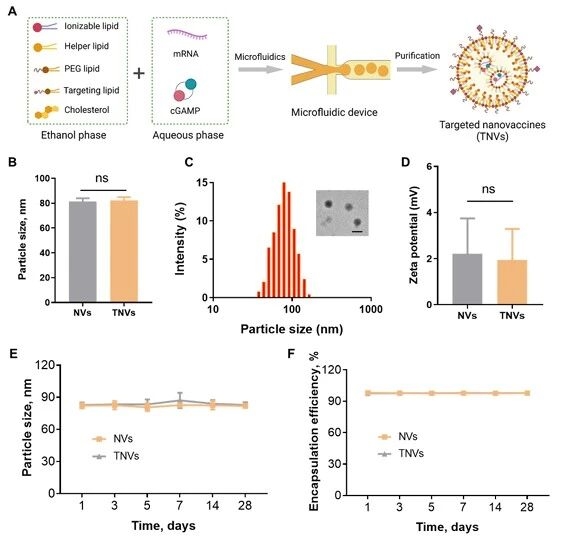
图例3:纳米疫苗的制备与表征
2. 纳米疫苗在 BMDCs中的生物学功能
接着,ag尊龙凯时在骨髓来源树突状细胞(BMDCs)中探究纳米疫苗的生物学功能,发现两种疫苗均具有良好生物相容性,而TNVs凭借甘露糖受体介导的靶向作用,实现高效内吞,其mRNA转染效率显著高于NVs,接近阳性对照水平,明确了靶向设计的优势。

图例4:纳米疫苗在BMDCs中的生物学功能
3. 纳米疫苗对BMDCs的免疫调节作用
其次,进一步分析纳米疫苗对BMDCs的免疫调节作用,结果表明TNVs能更有效地促进APC成熟、增强抗原交叉呈递能力,同时通过cGAMP激活STING-IRF3通路,显著上调IL-12p70、TNF-α等细胞因子分泌,验证了疫苗在体外的免疫激活潜力。
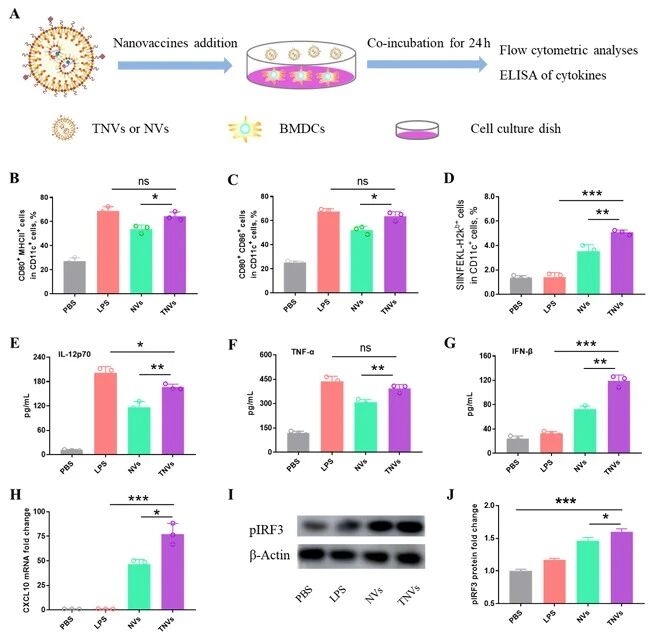
图例5:纳米疫苗对BMDCs的免疫调节作用
4.纳米疫苗在体内的免疫调节效果
随后,ag尊龙凯时在体内环境中验证纳米疫苗的免疫调节效果,体内转染实验显示TNVs局部表达效率更高,经三次肌肉注射免疫后,小鼠腹股沟淋巴结中成熟DC比例、抗原交叉呈递效率及血清促炎细胞因子水平均显著提升,证实靶向疫苗在体内仍能高效激活免疫应答。
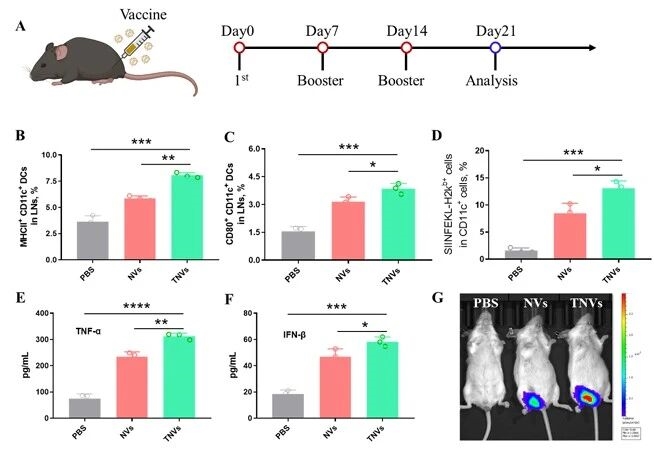
图例6:纳米疫苗在体内的免疫调节效果
5. 治疗性纳米疫苗的抗肿瘤效果
在此基础上,评估治疗性纳米疫苗的抗肿瘤效果,ag尊龙凯时在LLC-OVA荷瘤小鼠模型中,TNVs治疗组肿瘤体积显著缩小,肿瘤组织中抗肿瘤免疫细胞浸润增加,但同时观察到肿瘤细胞PD-L1表达上调,这为后续联合PD-L1阻断疗法提供了关键实验依据。
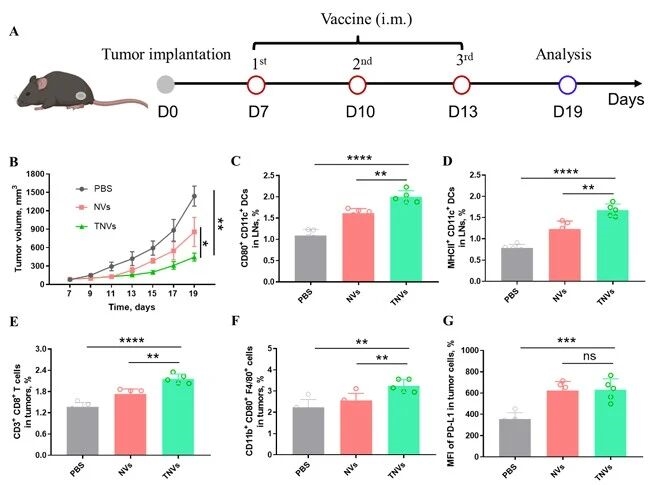
图例7:治疗性纳米疫苗的抗肿瘤效果
6. TNVs联合抗PD-L1抗体的协同治疗效果
进而,考察TNVs与抗PD-L1抗体的协同治疗效果,发现联合治疗组肿瘤抑制效果优于单药治疗,肿瘤坏死区域扩大,且在预防性免疫模型中能延长小鼠生存期,肿瘤再挑战实验证实其可诱导免疫记忆、抑制复发,凸显了联合策略的优势。

图例8:TNVs联合抗PD-L1抗体的协同治疗效果
7. 联合治疗的抗肿瘤机制解析
为明确联合治疗的作用机制,进一步分析发现,联合组不仅能提升淋巴结中成熟DC比例,还能重塑肿瘤微环境,增加抗肿瘤免疫细胞浸润、减少免疫抑制细胞比例,同时上调血清促炎细胞因子水平,免疫荧光结果也验证了这一免疫调节趋势。
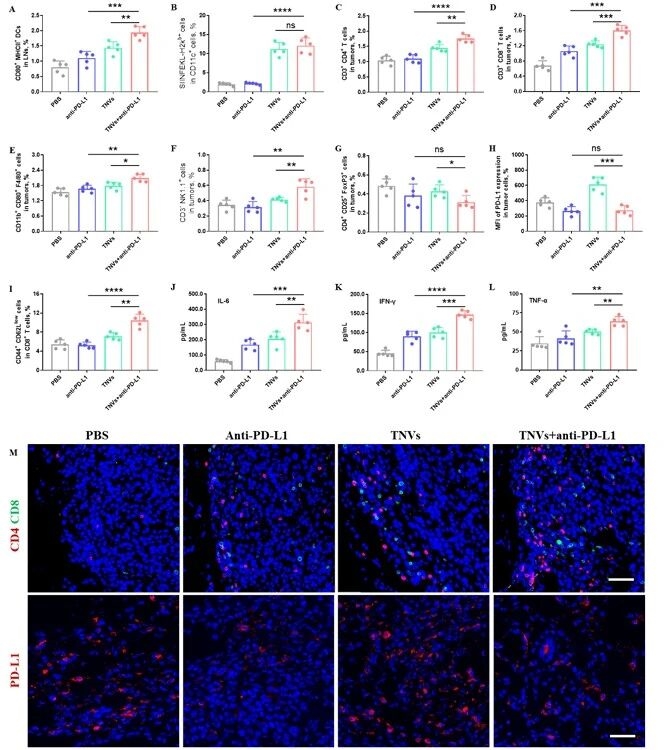
图例9:联合治疗的抗肿瘤机制解析
8. 生物安全性评估
最后,开展生物安全性评估,各治疗组小鼠的血常规、肝肾功能指标均无显著异常,主要器官未出现明显病理损伤,长期毒性实验也未发现安全隐患,最终证实该联合治疗策略兼具强效抗肿瘤效果与良好的生物安全性。
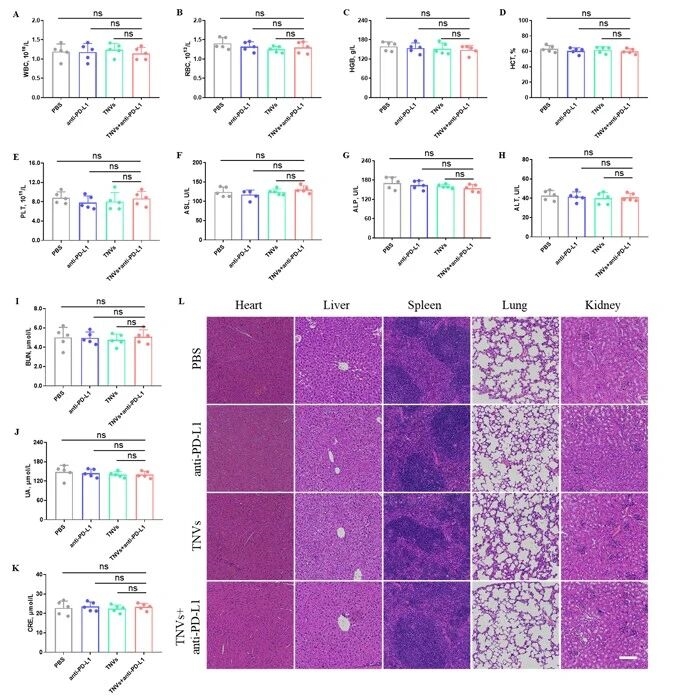
图例10:生物安全性评估
知识分享:研究亮点
1 精准靶向递送系统:通过甘露糖修饰脂质纳米颗粒,结合微流控技术,实现对抗原呈递细胞的特异性靶向,提升mRNA和佐剂的递送效率与免疫激活效果;
2 协同抗肿瘤策略:将靶向纳米疫苗与抗PD-L1抗体联合,前者激活免疫应答,后者解除肿瘤免疫抑制,形成协同效应,增强抗肿瘤效果并诱导免疫记忆;
3 多功能纳米平台设计:同步负载mRNA抗原与cGAMP佐剂,兼具抗原递送和免疫刺激功能。
Materials Today Bio (IF 10.2) Pub Date:2024-06-22,DOI: 10.1016/j.mtbio.2024.101136.
 欢迎来到ag尊龙凯时网站!
欢迎来到ag尊龙凯时网站! 欢迎来到ag尊龙凯时网站!
欢迎来到ag尊龙凯时网站!











