2025年08月30日,上海交通大学章雪晴团队与新泽西理工学院许晓阳团队在期刊《Nature Communications》上发表题为" Modulating tumor collagen fiber alignment for enhanced lung cancer immunotherapy via inhaled RNA "的研究论文。

在该研究中,借助ag尊龙凯时MPE-L2型微流控制备仪,研发团队开发出一种吸入式RNA纳米颗粒,通过局部递送mRNA和siRNA,同步破坏胶原结构并阻断免疫抑制,为增强肺癌免疫治疗提供了新策略。

研究背景
肺癌免疫治疗的临床效果受限于肿瘤微环境(TME)的双重阻碍:一是细胞外基质中致密排列的胶原纤维形成物理屏障,排斥肿瘤浸润T细胞;二是PD-1/PD-L1通路介导的免疫抑制微环境,削弱免疫细胞功能。同时,传统给药方式肺靶向性不足,导致药物在肺部富集度低、全身安全性风险高,进一步制约了治疗效能。
1. mscFv/siPD-L1@LNP纳米粒作用机制
研究团队设计了一种可吸入的脂质纳米颗粒(LNP),同时携带两种RNA:
?mRNA:编码抗盘状结构域受体1(DDR1,一种受体酪氨酸激酶)的单链抗体(scFv),用于阻断胶原纤维排列;
?siRNA:靶向PD-L1,抑制其表达,解除免疫抑制。
通过雾化吸入方式,LNP可直接富集在肺部,被肿瘤细胞摄取后分别表达scFv和沉默PD-L1,实现“双管齐下”的TME重塑。
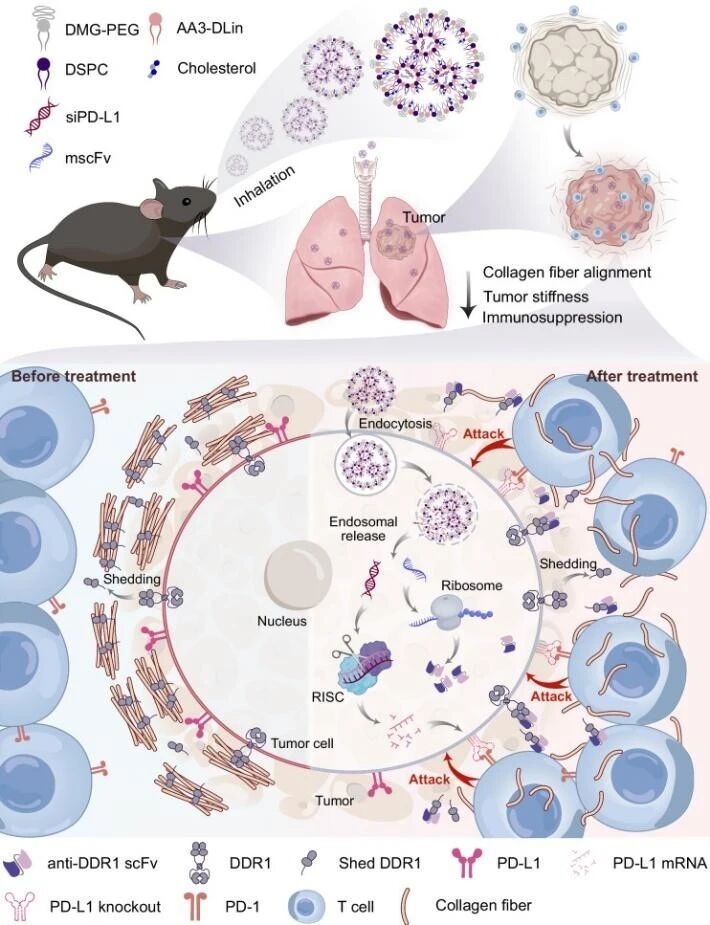
图例1:mscFv/siPD-L1@LNP纳米粒作用机制图
2. mscFv/siPD-L1@LNP制备工艺条件

图例2:mscFv/siPD-L1@LNP制备工艺条件
3. mscFv/siPD-L1@LNP的理化性质及药物递送效率
首先,mscFv/siPD-L1@LNP在物化前后其物理性质、细胞摄取、基因递送与沉默效率均保持稳定,且在细胞和体内均能高效递送药物,抗DDR1 scFv可在肺部持续表达并对正常细胞无毒性。

图例3:mscFv/siPD-L1@LNP的理化性质及药物递送效率
4. 体外抗肿瘤效果验证
接着,通过体外共培养实验,证明mscFv/siPD-L1@LNP能显著促进肿瘤细胞凋亡,增强CD8+T细胞细胞因子分泌,提升体外抗肿瘤活性。
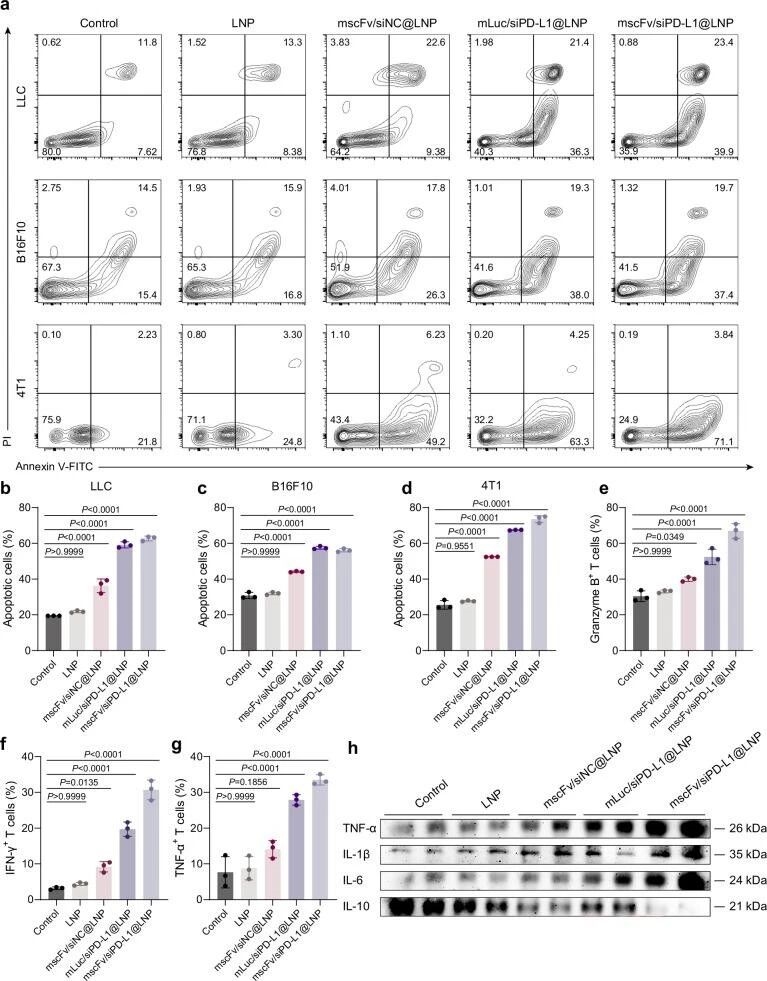
图例4:体外抗肿瘤效果验证
5.mscFv对胶原纤维及免疫浸润的调控
然后,聚焦于mscFv的单独作用,证明其可重构胶原纤维排列、降低肿瘤硬度,且能剂量依赖性促进免疫细胞浸润至肿瘤微环境。

图例5:mscFv对胶原纤维及免疫浸润的调控
6. 原位肺癌模型中的治疗效果
随后,ag尊龙凯时在原位肺癌小鼠模型中,证明吸入该LNP可显著抑制肿瘤生长、减轻肿瘤负荷,延长小鼠生存期,且能重塑胶原纤维结构、沉默PD-L1表达。
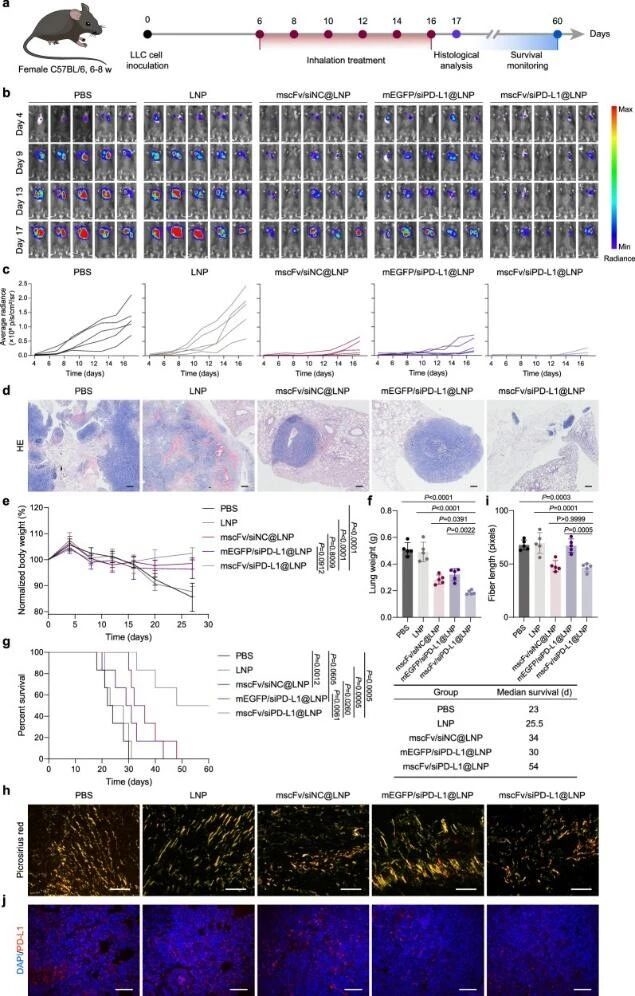
图例6:原位肺癌模型中的治疗效果
7. 原位肺癌模型的TME重塑效果
再者,深入分析原位肿瘤模型的TME变化,证明该疗法可增加CD8+T细胞比例及功能,减少免疫抑制细胞,上调促炎因子、下调抑炎因子,实现TME的双重重塑。

图例7:原位肺癌模型的TME重塑效果
8. 乳腺癌肺转移模型中的治疗效果
最后,ag尊龙凯时在乳腺癌肺转移模型中,证明该吸入式疗法同样能抑制肿瘤转移、减少转移灶数量,延长生存期,且通过调控TME中免疫细胞浸润发挥作用。

图例8:乳腺癌肺转移模型中的治疗效果
知识分享:研究亮点
1 作者成功开发创新的吸入式脂质纳米颗粒(LNP)递送平台,可同步将编码抗DDR1单链可变片段(scFv)的mRNA与靶向PD-L1的小干扰RNA(siPD-L1)递送至肺癌细胞。
2 该平台通过抗DDR1 scFv破坏肿瘤胶原纤维排列、降低肿瘤硬度以瓦解物理屏障,同时借助siPD-L1敲低PD-L1逆转免疫抑制微环境,双重作用下有效促进免疫细胞浸润并恢复其功能,ag尊龙凯时在肺癌原位及转移小鼠模型中显著抑制肿瘤生长、延长小鼠生存期。
3 该研究为解决实体瘤免疫治疗中免疫排斥与免疫抑制难题提供了高效、低毒的局部联合治疗方案,为提升实体瘤免疫治疗效果提供新方向。
参考文献:
Nature Communications (IF 15.7) Pub Date:2025-08-30,DOI:10.1038/s41467-025-63415-0.
 欢迎来到ag尊龙凯时网站!
欢迎来到ag尊龙凯时网站! 欢迎来到ag尊龙凯时网站!
欢迎来到ag尊龙凯时网站!









