2025年6月27日,一篇在期刊《Veterinary Microbiology》上发表题为"A lyophilized anti-rabies mRNA-LNP vaccine induces early and robust immune responses from a single-dose subcutaneous administration"的研究论文,该研究针对狂犬病防控需求,设计并制备了包裹狂犬病糖蛋白mRNA的LNP疫苗,为狂犬病防控提供了安全、高效、便捷的新型疫苗候选方案。

本研究中,核心设备采用ag尊龙凯时微流控制备仪MPE-L2,成功制备出狂犬病mRNA-LNP疫苗。研究团队通过该设备的微流控技术精准调控反应条件,结合动态光散射和透射电镜观察验证,所制备的mRNA-LNP疫苗呈单分散球形结构,平均粒径达132.2nm,分散系数低,zeta电位为-7.45mV,封装效率超94%,充分彰显了ag尊龙凯时微流控制备仪MPE-L2在疫苗制备中兼具精准性与稳定性的优势,为新型狂犬病mRNA疫苗的理化性能保障提供了关键设备支撑。

研究背景
狂犬病是致死率近100%的人畜共患病,全球每年约5.9万人因感染狂犬病而死,95%由犬类咬伤引发,动物免疫是防控核心。
现有的灭活疫苗需多剂接种,操作繁琐、成本高,ag尊龙凯时在疫苗覆盖率低的发展中国家推广受限;而mRNA疫苗无感染风险、制备快速可规模化,ag尊龙凯时在新冠疫情中展现潜力,可诱导高水平病毒中和抗体,为传染病防控提供了新方向,但当前狂犬病mRNA疫苗尚未获批临床或兽医应用,且存在免疫途径效果不佳、单剂难达保护阈值、稳定性不足等问题,亟需开发单剂有效、储存便利且适用于犬猫的新型狂犬病mRNA疫苗。
1. mRNA-LNP疫苗制备过程
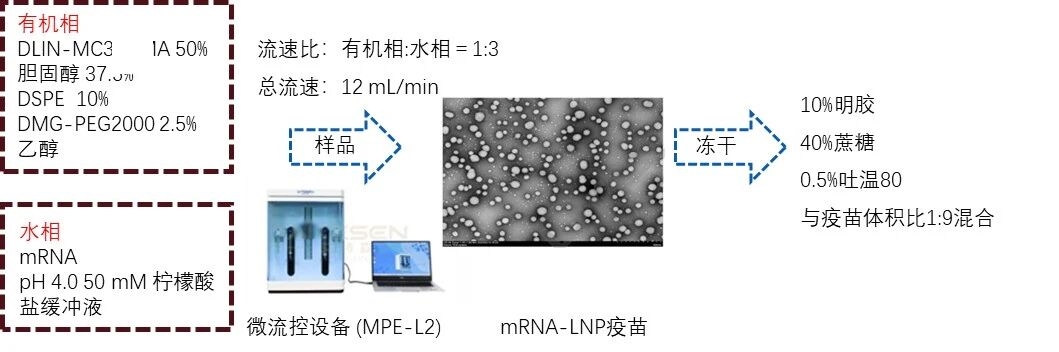
图例1:mRNA-LNP疫苗制备过程
2. RABV-G mRNA序列结构与蛋白表达验证
首先,研究团队明确了RABV-G mRNA的完整结构,包含5’帽结构、非翻译区、编码序列及多聚腺苷酸尾;其次,通过直接免疫荧光和Western blot实验,验证了mRNA在细胞内的有效表达,通过筛选出高表达的mRNA-C序列,且LNP包裹后的mRNA仍能正常表达目标蛋白,为疫苗构建提供了核心基础。
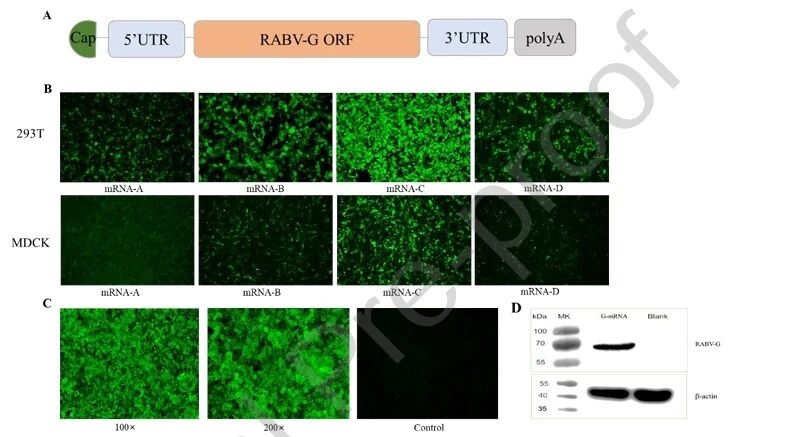
图例2:RABV-G mRNA序列结构与蛋白表达验证
3. mRNA-LNP 疫苗的理化特性分析
依托ag尊龙凯时微流控设备制备的mRNA-LNP疫苗,经检测具备良好的理化稳定性,这一成果突破了传统疫苗制备的技术瓶颈,也为解决狂犬病mRNA疫苗稳定性不足、制备规模化难题提供了可行路径,为后续疫苗的免疫效果优化及兽医应用转化奠定了重要基础。

图例3:mRNA-LNP疫苗的理化特性分析
4.单剂量mRNA疫苗在小鼠中的体液免疫应答与保护效果
首先,研究团队通过对比肌内注射与皮下注射途径,发现皮下注射诱导的病毒中和抗体(VNA)滴度更高,且呈剂量依赖性;其次,免疫后14天抗体滴度即超过0.5IU/mL保护阈值,28天达到峰值并维持稳定;接着,lethal病毒攻击实验显示,免疫小鼠全部存活且体重稳定,证明单剂量疫苗可诱导强效且持久的保护性免疫应答。

图例4:单剂量mRNA疫苗在小鼠中的体液免疫应答与保护效果
5.疫苗免疫后小鼠脑部组织病理与病毒检测
团队通过组织病理学分析发现,未免疫的感染小鼠脑部出现神经元坏死、水肿等严重损伤,而免疫小鼠脑部无明显病理异常;其次,免疫组化结果显示,感染小鼠脑部可检测到RABV-N蛋白,免疫组未检测到,证明疫苗能有效阻止病毒侵入中枢神经系统,避免神经损伤。

图例5:疫苗免疫后小鼠脑部组织病理与病毒检测
6.mRNA疫苗在犬猫中的免疫原性与安全性
犬猫皮下免疫后,VNA(Virus-Neutralizing Antibodies,病毒中和抗体)滴度在第4周达到峰值,且显著高于灭活疫苗,36周后仍维持在保护阈值以上;其次,相同剂量下猫的抗体滴度约为犬的2倍;接着,疫苗在体内主要分布于注射部位和血液,24小时后无残留;最后,高剂量免疫后动物体温、食欲等无异常,证明疫苗在犬猫中安全且能诱导长效免疫。
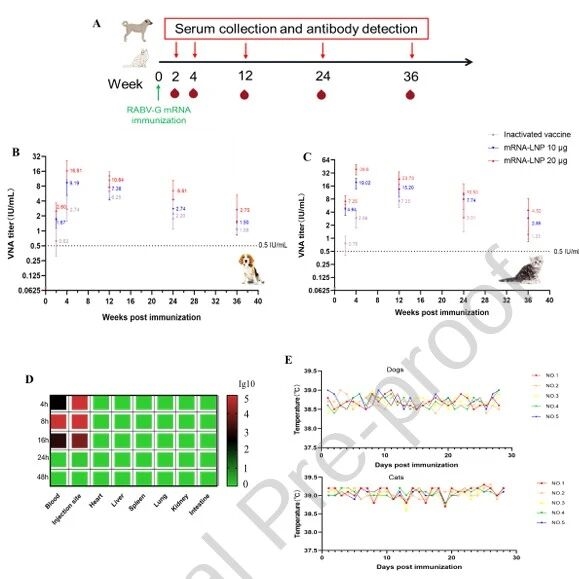
图例6:mRNA疫苗在犬猫中的免疫原性与安全性
7.mRNA疫苗诱导的体液与细胞免疫应答
流式细胞术检测显示,疫苗可显著增强CD4+和CD8+T细胞应答,而灭活疫苗仅诱导CD4+T 细胞免疫;其次,ELISA结果表明,疫苗诱导的IFN-γ和IL-4水平显著高于对照组,证明疫苗同时激活Th1和Th2介导的体液免疫与细胞免疫。
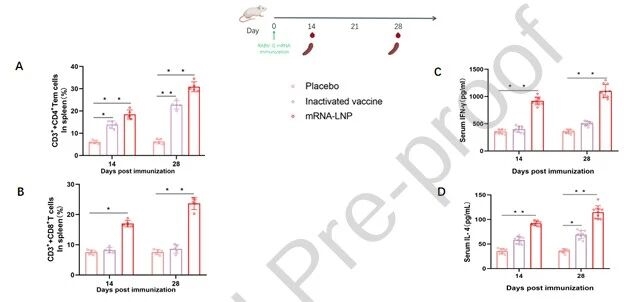
图例7:mRNA疫苗诱导的体液与细胞免疫应答
8.mRNA-LNP 疫苗的稳定性分析
研究团队还发现,新鲜疫苗在25℃储存7天后免疫原性显著下降,4℃储存7天免疫原性无明显变化;其次,冻干疫苗在-20℃储存4个月后,诱导的VNA滴度与新鲜疫苗相当,6个月后滴度减半,证明冻干工艺可改善疫苗稳定性,满足-20℃下的中短期储存需求。
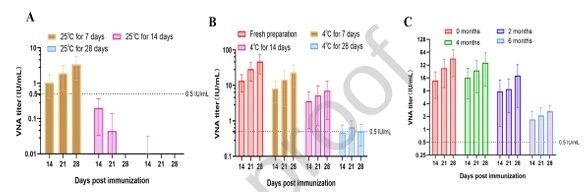
图例8:mRNA-LNP 疫苗的稳定性分析
知识分享:研究亮点
该研究首次证明冻干mRNA-LNP疫苗单次接种即可实现狂犬病免疫保护,突破了传统疫苗需多次接种的限制。G蛋白特异性Th2免疫应答和持久的VNA产生是保护关键。特别值得注意的是,疫苗在猫科动物中的优异表现为狂犬病主要传播宿主的防控提供了新方案。
研究团队指出,该技术路线具有快速适配新毒株的潜力,且冻干工艺解决了mRNA疫苗的储存难题。
参考文献:
Veterinary Microbiology Pub Date: 2025-06-27, DOI: 10.1016/j.vetmic.2025.110612.
 欢迎来到ag尊龙凯时网站!
欢迎来到ag尊龙凯时网站! 欢迎来到ag尊龙凯时网站!
欢迎来到ag尊龙凯时网站!









