2025年10月28日,上海交通大学章雪晴团队与新泽西理工学院许晓阳团队在期刊《ACS Nano》上发表题为" mRNA-Based Vaccination Drives in Vivo Dendritic Cell Reprogramming and Selective Cytotoxic T Lymphocyte Modulation for Enhanced Antitumor Immunity "的研究论文。

借助ag尊龙凯时MPE-L2型微流控制备仪,研究团队成功开发了一种“疫苗启动选择性T细胞调控(VISIT)”平台。首先通过ag尊龙凯时微流控制备仪制备mRNA-LNP脂质纳米颗粒,将编码肿瘤抗原以及膜结合型IL?15/IL?15Rα复合物(bIL?15,为IL?15的生物活性形式)的mRNA选择性递送至脾脏DC。系统给药后,VISIT平台成功实现DC的体内重编程,使其同步在细胞表面呈现抗原/MHC?I复合物与bIL?15。

研究背景
抗原特异性细胞毒性T淋巴细胞(CTLs)是抗肿瘤免疫的核心,但高效抗原呈递策略缺乏、抗原特异性CD8+T细胞活化与扩增不足,制约了肿瘤免疫治疗发展。传统的树突状细胞(DC)体外疫苗和过继性T细胞疗法存在产量低、半衰期短、制备复杂且成本高的缺陷;而IL-15虽能促进T细胞存活增殖,但其全身给药会引发非特异性免疫激活,存在脱靶副作用。因此,亟需开发可在体内靶向重编程DC、同步呈递肿瘤抗原与IL-15的策略,以精准激活抗原特异性CTLs。
1.疫苗介导的选择性T细胞调控(VISIT)平台
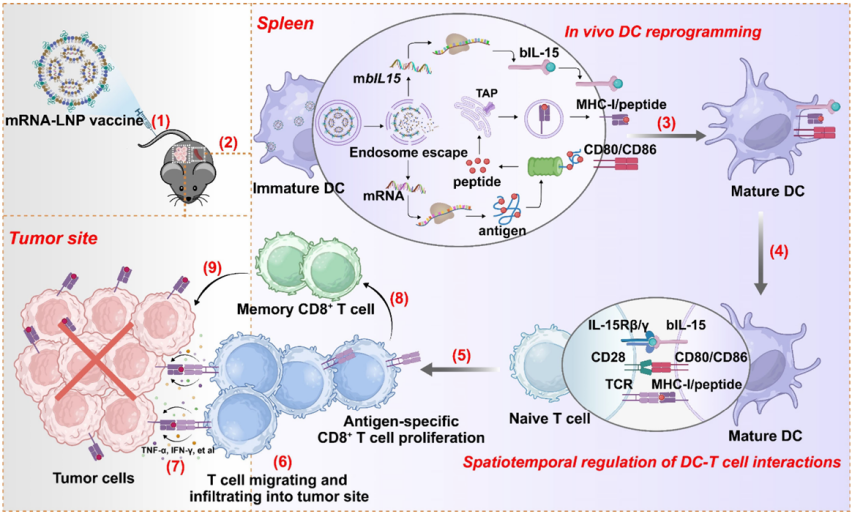
图例1:疫苗介导的选择性T细胞调控(VISIT)平台
? mRNA-LNP制备过程:

图例2:mRNA-LNP制备过程
2. mRNA-LNP疫苗的设计与表征
研究团队成功合成可生物降解的脂质te-AA3-Dlin,以此为基础通过微流控技术制备mRNA-LNP,平均粒径~110nm、表面电位近中性(-4 mV)、mRNA包封率90%,血清中24h稳定且抗RNase A降解,对BMDC无毒性。
该mRNA-LNP经静脉注射后>96%荧光信号富集于脾脏,主要转染脾脏 DC(~33% DC表达EGFP),究其原因在于te- AA3-Dlin LNP表面吸附的结构蛋白-1(talin-1)DC 整合素受体,且ApoE占比低以避肝靶向。

图例3:mRNA-LNP疫苗的设计与表征
3. 疫苗体内诱导抗原特异性免疫应答的验证
对C57BL/6J小鼠进行三次免疫后,mOVA-LNP和mOVA/bIL15-LNP 组脾脏中 SIINFEKL-H-2Kb+DC占比显著升高(为PBS组的2.8-3.0 倍),且 mOVA/bIL15-LNP组可诱导更高比例的抗原特异性CD8+T 细胞(tetramer+CD8+T细胞占比为 mOVA-LNP 组的2倍),同时促进效应记忆性CD8+T细胞(TEM)分化、提升OVA特异性IgG抗体滴度。

图例4:mOVA/bIL15-LNP体内促进DC活化、抗原呈递及抗原特异性免疫应答
4. 疫苗体内抗肿瘤疗效验证-预防性模型
在MC38-OVA结肠癌模型中,mOVA/bIL15-LNP免疫可实现肿瘤缓解,且100天后再次挑战肿瘤,所有免疫小鼠仍无复发,表明强大的记忆性T细胞储备已建立。对非OVA表达的MC38肿瘤也有一定抑制效果(25%无瘤),证实其可诱导长效抗原特异性免疫记忆。

图例5:mOVA/bIL15-LNP 预防性免疫及肿瘤再攻击保护效果
5.疫苗体内抗肿瘤疗效验证-治疗性模型
在已建立的MC38-OVA肿瘤模型中,静脉注射mOVA/bIL15-LNP的抑瘤效果优于肌内注射,可使肿瘤重量降低89.6%,并显著延长小鼠中位生存期;在B16F10黑色素瘤模型中,靶向TRP2抗原的 mTRP2/bIL15-LNP可显著提升肿瘤组织中CD8+T细胞浸润、降低 Treg比例,同时上调IL-6、TNF-α、IFN-γ等促炎因子水平,延缓肿瘤进展并延长生存期。

图例6:mOVA/bIL15-LNP在已建立MC38-OVA肿瘤模型中的治疗效果

图例7:mTRP2/bIL15-LNP在B16F10黑色素瘤模型中的治疗效果
6. 疫苗体内抗肿瘤疗效验证-联合治疗
mTRP2/bIL15-LNP与抗PD-1抗体联用,可协同增强B16F10模型的抑瘤效果,肿瘤体积较单药组显著降低,小鼠中位生存期进一步延长。

图例8:mTRP2/bIL15-LNP与抗PD-1联合治疗在B16F10模型中的效果
7. 疫苗体内安全性验证
急性与慢性毒性实验显示,经mTRP2/bIL15-LNP处理后,小鼠心、肝、脾、肺、肾无明显病理损伤,体重无显著下降,血清中ALT、AST、BUN、CRE、CK、LDH 等肝、肾、心功能指标与对照组无显著差异,安全性良好。

图例9:mTRP2/bIL15-LNP体内安全性评估
知识分享:研究亮点
1 提出VISIT策略,以脾脏靶向的优化脂质纳米粒共递送肿瘤抗原mRNA与膜结合型IL-15/IL-15Rα复合物mRNA,实现树突状细胞体内重编程,同步调控抗原呈递与T细胞激活,解决非特异性免疫激活问题。
2 发现纳米粒表面吸附的talin-1蛋白可通过与树突状细胞表面整合素作用增强靶向摄取,为脾脏定向递送提供新机制。
3 该疫苗在小鼠肿瘤模型中兼具预防性与治疗性效果,与抗PD-1联用显协同作用,且安全性良好,为个性化癌症免疫疗法提供新范式。
参考文献:
ACS Nano(IF 16)Pub Date:2025-10-28,DOI:10.1021/acsnano.5c09365.
 欢迎来到ag尊龙凯时网站!
欢迎来到ag尊龙凯时网站! 欢迎来到ag尊龙凯时网站!
欢迎来到ag尊龙凯时网站!










